Đơn vị sản xuất thuốc trong nước có thể liên hệ MPP để sản xuất Molnupiravir
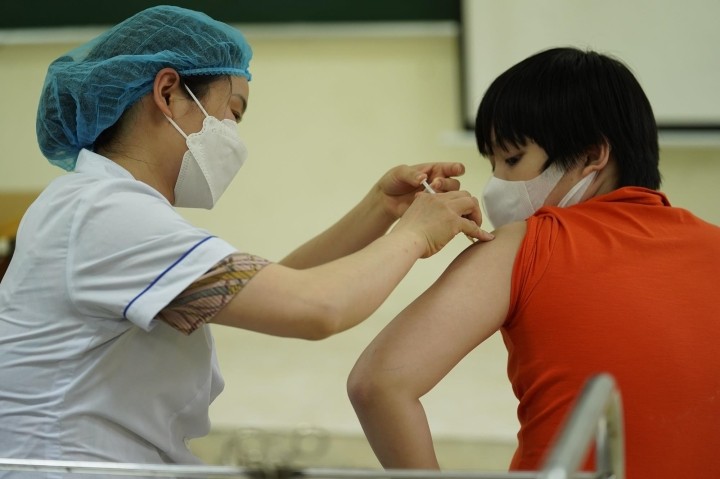
Ngày 1/11, Tập đoàn dược phẩm MSD đã có công văn thông báo họ đã ký thỏa thuận với Quỹ Bằng sáng chế thuốc (Meidcines patent pool-MPP) và các cơ sở sản xuất muốn được nhượng quyền tự nguyện để sản xuất thuốc Molnupiravir sẽ nộp hồ sơ tới MPP.
Cục Quản lý Dược (Bộ Y tế) mới đây đã có công văn gửi Hiệp Hội Doanh nghiệp dược Việt Nam đề nghị Hiệp Hội Doanh nghiệp Dược Việt Nam (HHDN Dược Việt Nam) sớm thông báo đến các cơ sở sản xuất thuốc thành viên có nhu cầu liên hệ với Tập đoàn dược phẩm MSD hoặc Quỹ Bằng sáng chế thuốc (Meidcines patent pool-MPP) để nộp hồ sơ nhằm trở thành đối tác nhượng quyền tự nguyện sản xuất thuốc Molnupiravir.
 |
| TP.HCM là địa phương đầu tiên triển khai chương trình này, đến nay chương trình đã mở rộng đến 34 tỉnh, thành. Bộ Y tế đã cấp 110.000 liều (gồm 50.000 liều Molnupiravir 400 mg Stella VN và 60.000 liều Molnupiravir 200 mg Optimus do Ấn Độ sản xuất) cho các địa phương, trong đó 5.000 liều vừa được Bộ Y tế cấp bổ sung cho TP.HCM. |
Cục Quản lý Dược đề nghị HHDN Dược Việt Nam thông tin tới các cơ sở sản xuất thuốc thành viên có nhu cầu khẩn trương truy cập thông tin để đăng ký trở thành đối tác nhượng quyền tự nguyện sản xuất thuốc chứa phối hợp PF 07321332 và Ritonavir. Đây là thuốc kháng virus mới có tác dụng hỗ trợ điều trị Covid-19.
Được biết, trước đó Cục Quản lý Dược (Bộ Y tế) cũng có công văn gửi Hiệp hội đề nghị Hiệp hội thông tin tới các cơ sở sản xuất thuốc thành viên có nhu cầu khẩn trương liên hệ với Công ty Pfizer hoặc MPP để nộp hồ sơ đề nghị trở thành đối tác nhượng quyền tự nguyện sản xuất thuốc điều trị Covid-19 Paxlovid (chứa phối hợp PF-07321332 và Ritonavir).
Cả nước hiện đã có 5 công ty dược nộp hồ sơ sản xuất thuốc kháng virus điều trị Covid-19. Do trong nước hiện chưa có thuốc Molnupiravir được cấp số đăng ký lưu hành nên Bộ Y tế đang xem xét các vấn đề về pháp lý, chuyên môn để đề xuất, trình Chính phủ chấp thuận cấp số đăng ký lưu hành thuốc kháng virus này trong tình huống phòng chống dịch khẩn cấp, với một số điều khoản về hồ sơ được rút gọn nhưng vẫn bảo đảm về an toàn và hiệu quả. Nếu được Chính phủ cho phép, Bộ Y tế sẽ cấp số đăng ký lưu hành thuốc trên cho các công ty dược trong nước sản xuất, chấp nhận cắt giảm một số yêu cầu về hồ sơ thử nghiệm lâm sàng.
Vào tháng 8/2021, thuốc Molnupiravir đã được Bộ Y tế thí điểm điều trị F0 có triệu chứng nhẹ tại nhà ở TP HCM. Hiện đã có 34 tỉnh, thành điều trị có kiểm soát bằng thuốc kháng virus Molnupiravir cho bệnh nhân Covid-19 nhẹ và không triệu chứng tại nhà.
Bộ Y tế cho biết, theo thống kê cho thấy thuốc Molnupiravir có tính an toàn cao, dung nạp tốt, hiệu quả rõ rệt về giảm tải lượng virus, giảm lây lan, giảm chuyển nặng, rút ngắn thời gian điều trị sau 5 ngày bệnh nhân bị dương tính. Ngoài ra, tỉ lệ chuyển nặng rất thấp từ 0,02%-0,06% và không có ca nào tử vong.